TOPICS【東京大学大学院新領域創成科学研究科 鈴木 穣教授】10年先の医療のために。遺伝子解析の精度と手法を磨き上げる学術ネットワークのハブ的研究拠点
SCROLL

- 一般社団法人柏の葉オーミクスゲート
- 東京大学 柏キャンパス・柏Ⅱキャンパス・柏の葉キャンパス駅前サテライト

東京大学大学院
新領域創成科学研究科
メディカル情報生命専攻
生命システム観測分野
鈴木研究室
鈴木 穣(ゆたか)教授
遺伝子解析の方法論開発を行い、製薬企業や国立がん研究センター等の病院機関とも連携。得られた技術の医療や多分野への応用等を試みています
遺伝子解析技術は、がん治療のための医療最適化の基本診断に用いられるなど私たちの身近で活用されるようになりました。しかし、医療や製薬の分野で「実用」となるまでには10年間という長さでの研究が必要です。東京大学柏キャンパスにある鈴木研究室は、日本の遺伝子解析の方法論開発の拠点として、産学連携を進めながら、その「手法」の実用化、さらなる精度の向上、10年先の未来の医療の構想・提言に取り組んでいます。
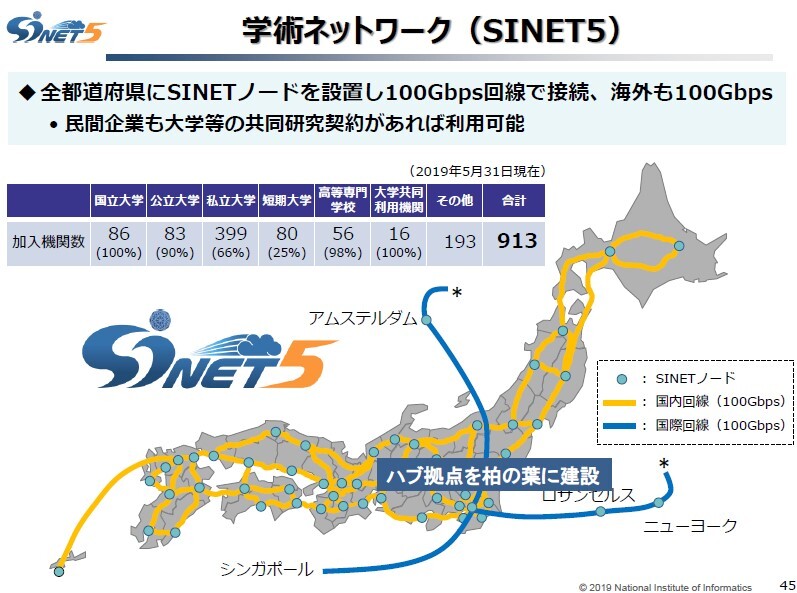
学術情報ネットワーク(SINET)は、国立情報学研究所(NII)が構築、運用している情報通信ネットワーク。全国の大学や研究機関等に対して先進的なネットワークを提供するとともに、多くの海外研究ネットワークと相互接続しています
柏の葉の街だから新しい知のチャレンジができる
東京大学柏キャンパスは、同大の伝統ある本郷や駒場に次ぐ第3の主要キャンパスとして2000年に誕生しました。学問体系の根本的な組み換えも視野に入れた「知の冒険」を目指す学問・研究拠点です。鈴木穣教授は、ここで遺伝子解析の研究に取り組んでいますが、「柏の葉という街にできたキャンパスだから可能だったこと」があると言います。
人のゲノム(その生物の遺伝子全体)が解析されたのは2000年代前半。2000年代後半になると膨大なシークエンシング(遺伝子解析)が可能なシークエンサー(遺伝子解析装置)が日本にも導入されます。この新しい技術で何ができるのか、次々に開発が進む機器の有用性はどれくらいか。そうした新たな学問領域にチャレンジすることが、鈴木研究室の基本的なミッションとなったのです。
「ここには広大な原野が広がっています。それは、実際の自然環境や施設の広さや余裕という物理的な話だけではありません。この街には、東京大学のほかにも千葉大学や国立がん研究センター東病院など、大学・医療機関・研究機関など、最先端の知が集結しています。自身の専門分野や同じ領域の世界にいると、その中での役割分担を重んじ、新しいことを始めることは難しいものです。しかし、ここでは、それぞれの研究努力が知の原野を広げていけるのです。組織を超えた共同研究も盛んで、一緒にこの原野を開拓していこう、盛り上げていこう、自然とそうした気持ちを共有できる雰囲気があります」と鈴木教授。
例えば、がんゲノム研究において、当地の国立がん研究センター東病院での臨床研究、産業技術総合研究所が開発したロボットによる大量の遺伝子解析などを組み合わせることで、世界の先端レベルの研究に取り組むことも構想中です。さらに、全国の大学や研究機関等の学術情報基盤として運用されている学術情報ネットワークを介して、鈴木研究室による遺伝子解析の研究成果や知見が国内さらには海外にも共有されています。常に新たなミッションにチャレンジしながら、鈴木研究室の役割は進化を続けています。
では、遺伝子解析とは、具体的に私たちの生活にどう役立っているのでしょうか。一番身近な例は、がん治療の診療方針の判断材料とするもので「がんの最適化医療」と呼ばれています。かつては国家プロジェクトであったゲノムの遺伝子解析は、解析機器の発達により、この10年で急激なコストダウンが実現しました。日本では2019年6月からがん遺伝子の検査が保険適用になっています。
「がん治療に用いられる抗がん剤の一部は、細胞をがん化する特定の遺伝子変異を持つ場合にのみ効果を発揮します。同じがんでも、その遺伝子変異を持たない患者さんに投与しても効果はなく、場合によっては副作用でより重篤化してしまう危険性もあります。そのため、現在ではがん腫瘍を切り取り、遺伝子検査をすることが義務付けられたのです。さらに抗がん剤の効果が期待できなくなる遺伝子変異を見つけて、治療の継続をやめる判断も遺伝子解析の結果を参考にしています」と鈴木教授は話します。
こうした医療の現場に遺伝子検査の手法が「実装」されるまでには、世界中の研究や知見の集約があり、10年規模の歳月を必要とします。鈴木研究室では、全国からの依頼に応え、週に100人以上の遺伝子解析を行いながら、新たな手法、より精度の高い解析方法を模索しています。
世界のゲノム解析の研究レースは新たなスタートを切ったばかり

鈴木研究室。全国から依頼される遺伝子解析を週に100件以上行っている。そうしたデータに基づき、遺伝子解析の精度を高める新たな手法の研究、応用のための技術の模索が続けられている
ヒトゲノムは30億個の塩基対からなる長大なものですが、2003年に解読が終了。現在では個人のゲノムが解読される時代を迎えています。しかし、それが人を構成する50兆個の細胞でどのように機能しているかは、まだ解明されていません。
「人の50兆個全ての細胞をゲノム解析してもそれは設計図にすぎません。それらが組み合わさり疾患の原因となっているかの解明は、これからのミッションです。実は、遺伝子解析研究の分野では、日本は世界に遅れをとっていました。しかし、この次世代ゲノム医療においては、これまでとは全く異なる発想の基礎医学研究が求められるパラダイムシフトが起きています。つまり、世界同時スタートの幕が切って落とされたばかりなのです」と鈴木教授は教えてくれました。
この研究レースには、遺伝子解析のニーズの多様化も影響し、3つの分野が注目されています。
●シングルセル解析技術
これまでの遺伝子解析し、細胞の塊のデータ分析をしていたのに対し、その中の「約1万個の細胞」を1個ずつ解析することで、どの遺伝子変異が疾患の要因かを見極める。前述の国立がん研究センター東病院や産業技術総合研究所とのがんゲノム研究構想はこれに当たります。
●ナノポアシークエンサー
ナノポアシークエンサーとは携帯可能な遺伝子解析装置で、従来の大規模データを扱う遺伝子解析に比べると精度は低いが、どこでも検査でき、すぐに結果が分かります。医療設備が乏しい土地でもエボラ出血熱のウイルスを見つけることを可能にし、世界的に需要が高まっています。
●環境の遺伝子検査
ナノポアシークエンサーのような精度の低い検査キットを使い、水質や土壌、配水など、環境に含まれる遺伝子から安全性を見極めたり、安全性を高めたりすることへの活用が期待されている手法です。
「いずれの分野でも、遺伝子解析におけるパラダイムシフト(劇的な変化)を実感します。ナノポアシークエンサーを用いた遺伝子解析は、当研究室を含め、最新の遺伝子解析機器を持つ限られた研究機関しか参加できないレースです。これには日本の医療の特徴が有利に働くかもしれません。既に遺伝子検査を用いた最適化医療が標準化していることで、遺伝子データと診療情報がしっかりひも付いているからです。大規模データだからといって、何でもAIに任せるのではなく、ある程度の疾患との関連を整理することで、パラダイムシフトに適した新たな技術開発の可能性を模索しています」と鈴木教授は言います。
鈴木研究室の強みの1つは、遺伝子機器の性能に加え、検査試薬の工夫により従来手法では検出できなかった微量の遺伝子を見つけ、がん化のメカニズムを解明していく研究手法だそうです。こうした新たな手法を発想することにも、柏の葉という「街」の中で研究する環境が刺激になっているようです。
遺伝子で「街を診る」という未来の医療
「私はキャンパスから車で10分ほどの所に住んでいます。子どももここで育ち、成人しました。この街の住人として自分たちの研究が、未来の社会にどう役立つのかと考えることがあります。そうした思考も、柏の葉ならではの『効果』だと思います」と鈴木教授。
前述の「環境の遺伝子検査」は、今、遺伝子検査の話題の中でも最もホットなものだそうです。途上国であれ都市生活であれ、遺伝子変異の複合要因には環境とのイントラクション(相互作用)が考えられます。その複雑な関係を「環境に含まれる遺伝子を解析」することで『見える化』する。例えば、食物や飲料、人の排泄物を含む排水、時間や季節、場所、あらゆる生活と関わる環境に含まれる遺伝子を解析することで、クオリティ オブ ライフ(QOL)の向上が期待できるのではないかという新たな遺伝子解析の応用イメージです。
鈴木研究室では、新たな知の原野を開拓しながら、10年先の医療、未来の人々の生活に寄与する研究を続けています。

鈴木研究室がある柏キャンパス内の「柏Ⅱキャンパス産学官民連携棟」。柏地区におけるイノベーション拠点として、オープンラボ、生産技術研究所価値創造デザイン推進基盤、インキュベーション施設が入居して活動します。オープンラボでは、企業や自治体等と連携して、新規産業創出を目指し共同研究等を行います
※こちらのインタビューは柏の葉イノベーションフェス2020の記事を転載しているものになります。
MEMBER関連メンバー
FACILITY関連ファシリティ
PAGE TOP





